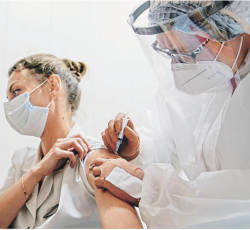
Así es el procedimiento para autorizar una vacuna para el Covid en Chile
Instituto de Salud Pública convocó a un comité de 22 expertos, pero su director reconoce que aprobación será similar a la que disponga EE.UU.
Fuente: La Tercera
En Chile no se llama aprobación de emergencia como en EE.UU., sino “solicitud para autorización provisional”, y se refiere a un mecanismo del Código Sanitario. “Se usa para cubrir una necesidad urgente de naturaleza colectiva, derivada de una situación de desabastecimiento o inaccesibilidad a un recurso farmacológico específico. En este caso, inmunizar a la población contra Covid-19”, explica Heriberto García Escorza, director (s) del ISP. Para aprobar el registro de una vacuna (u otro medicamento) el ISP evalúa antecedentes de la fabricación del componente activo y del producto.
También se consideran los antecedentes de los estudios preclínicos y los clínicos en fase uno, dos y tres. Es precisamente este último estudio, el que ninguna vacuna contra el coronavirus aún tiene listo y la razón por la que las agencias como la FDA y el ISP pueden hacer excepciones, como la que solicitó Pfizer.
La solicitud puede ser presentada por el laboratorio fabricante o su representante en Chile, quien se hace responsable de la veracidad y completitud de la información ingresada. Para eso, debe presentar antes el ISP estudios o documentos que den cuenta del proceso de manufactura y control de calidad del producto y los antecedentes que demuestran la eficacia y seguridad de la vacuna, entre los cuales los más relevantes son los estudios clínicos. “En el caso de una autorización de uso provisional, se requiere el respaldo documental de que el producto cuenta con aprobación en el país de procedencia o fabricación”, indica García.
Tras esta solicitud, evaluadores internos del ISP analizan los antecedentes presentados y al igual que la FDA en Estados Unidos, citarán a un comité de expertos para asesorar a la autoridad.
El director del ISP explica que no es obligación citar a estos asesores y no se hace siempre, pero como se trata de una vacuna “nueva y estamos en pandemia se recurrirá a ellos. “Hemos creado un comité de expertos que nos ayuda con los productos nuevos. Cuando amerita, se hace, pero es la agencia reguladora la que resuelve” , explica García.
Si aprueba la FDA, ¿aprueba también el ISP? Ambas son agencias regulatorias con el nivel más alto que otorga la OPS/OMS (Nivel IV, de Autoridad Reguladora de Referencia), pero García dice que no tienen una relación vinculante que las obligue a aprobar medicamentos al unísono. De hecho ha ocurrido que en EE.UU. se ha aprobado un medicamento, y en Chile no. “Ocurrió con unos anticuerpos monoclonales”, recuerda el director del ISP. En esa oportunidad, el laboratorio presentó antecedentes distintos a ambas agencias.
En esta ocasión la situación es distinta reconoce García, porque ambas agencias recibieron los mismos documentos, la diferencia está en el transporte que se necesitará en Chile y en Estados Unidos para mover las vacunas y que implican para la cobertura nacional, al menos 8 horas de avión. En este caso, la compañía debe presentar datos de estabilidad de vuelo y otros aspectos logísticos que difieren de la realidad estadounidense.
Incluso, como se trata de agencias del mismo nivel, pero autónomas, puede ocurrir que de manera excepcional en Estados Unidos, la vacuna de Pfizer se apruebe su uso durante el período de un año y en Chile se defina su utilización mientras dure la pandemia. “El reglamento que tenemos no dice tiempo. También podría dictarse una resolución que señalara que se permite el uso hasta que se cuente con los estudios fase 3. Esto lo hacemos todas las agencias reguladoras, pero lo más probable es que hagamos algo muy parecido a lo que apruebe FDA, los antecedentes presentados son los mismos”, indica.
Si es requisito, para la legislación nacional que para la autorización de excepción, la vacuna cuente con permiso de su país de origen. En este caso específico, de EE.UU. o de Bélgica, lo que aún no ha ocurrido. Que el Reino Unido la haya aprobado, no es más que otro antecedente que se presenta en la carpeta.
Comité de expertos
El comité de expertos al que llamó el ISP está constituido por 22 personas, de ellas, seis que no pertenecen a esta institución: un médico de la U. Católica; un pediatra broncopulmonar de la U. del Desarrollo, un químico farmacéutico doctorado de la U. de Valparaíso, otro de la U. Austral, otro doctorado sin filiación, un oncólogo de Clínica Indisa un pediatra infectólogo del Departamento de Inmunizaciones del Ministerio de Salud y otro pediatra infectólogo del Comité Asesor de Vacunas (Cavei). Desde el ISP, el equipo estará encabezado por el propio director.
Si la respuesta del ISP es positiva, se procede a la resolución, un proceso que puede demorar un par de días. “Una vez que autorizamos, el laboratorio tiene que hacer la importación con el documento que nosotros entregamos para que Aduanas permita su ingreso”, explica García.
Por cada lote de dosis que ingresen al país, el laboratorio deba hacer de manera online un formulario informando la cantidad que ingresa. Una vez que llegan al aeropuerto, se sacan de ahí y las dosis son llevadas a las cámaras de frío ya establecidas.
“Desde este punto, es el Programa Nacional de Inmunizaciones (PNI) del Minsal el que se hace cargo de la distribución según se haya decidido. Si todo sale como tiene que salir, al igual que en el resto de los países, se debería empezar a vacunar a la población el primer trimestre del próximo año”, explica el actual director (s) del Instituto de Salud Pública.
Recuadro
HERIBERTO GARCÍA, INSTITUTO DE SALUD PÚBLICA.
EL PASO A PASO DE UNA VACUNA EN EL PAÍS
El primer paso Ingresa solicitud de aprobación ante el Instituto de Salud Pública (ISP).
Análisis
Funcionarios del ISP, con o sin un comité de expertos, analizan la solicitud.
Resolución
Tras revisar los datos, el ISP decide si autoriza o no el uso del medicamento en el país.
Importación
Una vez aprobado su uso, se puede iniciar la importación de la vacuna.
Nueva solicitud
Para ello se debe realizar una solicitud de internación de productos.
Distribución
Tras ingreso de vacunas, almacenamiento y distribución quedan a cargo del Minsal.

 Fonasa
Fonasa Isapres de Chile
Isapres de Chile Ministerio de Salud
Ministerio de Salud Superintendencia de Salud
Superintendencia de Salud