ISP aprueba uso de la vacuna de CanSino, la cuarta autorizada contra Covid-19 en Chile
Con diez votos a favor, una abstención y dos votos de rechazo, el Comité de Expertos decidió la aprobación de emergencia de este nuevo fármaco.
Fuente: La Tercera
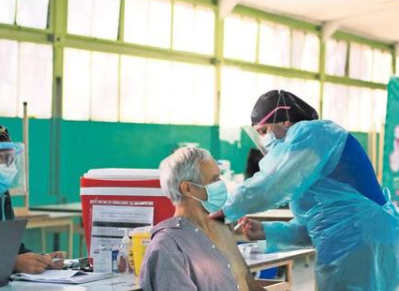
Convidicea (Ad5-nCoV). Así se llama la nueva vacuna aprobada por el Instituto de Salud Pública (ISP) para su uso en el país como protección contra el virus Sars-CoV-2, el causante de la actual pandemia de Covid-19.
La nueva vacuna autorizada y desarrollada por el laboratorio chino canadiense CanSino, es la primera que podrá ser utilizada en una sola dosis, un factor clave para la meta de vacunación que hoy tiene el país y que busca vacunar al 80% de la población.
Esta es la cuarta vacuna que el ISP aprueba para su uso en Chile, en diciembre del ario pasado autorizó la vacuna de Pfizer, a comienzos de enero de este año el uso de la vacuna Coronavac del laboratorio Sinovac Biotech, a fines de ese mes la vacuna desarrollada por el laboratorio farmacéutico británico AstraZeneca y la Universidad de Oxford.
Fue el laboratorio Sayal, quien hizo la presentación de la solicitud ante el ISP para el registro de emergencia para la importación y distribución en el país de su vacuna contra el coronavirus.
Según los estudios clínicos desarrollados hasta ahora, la vacuna logro una efectividad en el 65,7% de los casos sintomaticos (la recomendación de la Organización Mundial de la Salud es del 50%) y de 90,98% para los casos graves.
Tras casi tres horas de deliberación, la vacuna se aprobó con 11 votos a favor, una abstención y dos votos de rechazo.
Heriberto García, director (s) del ISP, señaló junto con la aprobación de la vacuna, es necesario que el laboratorio pueda completar la información que se requiere y que expusieron los expertos que decidieron su uso.
La vacuna de CanSino fue aprobada para su uso en adultos de mayores de 18 años y hasta los 60. “Los datos que se tienen es que con el tiempo se va perdiendo la respuesta inmune celular por lo que podría ocurrir que en estudios posteriores se defina una segunda dosis”, indicó García.
Las principales observaciones de los expertos tienen relación con la falta de información respecto de la duración de la inmunogenecidad, seguimiento de los pacientes, el tipo de inmunidad que genera y mayor explicación sobre los estudios y testeos, evaluación de desempeño, entre otros.
Quienes votaron a favor, destacaron que en el contexto de pandemia y considerando los beneficios de la vacuna, aprobaban su uso pero siempre considerando que es excepcional.
Fuera del país, esta vacuna tiene autorización de uso en China, México y Pakistán.
El próximo mes, deben llegar al país 1,8 millones de dosis, para proteger a igual número de personas.
Observaciones y rechazo
Caroline Weinstein, químico farmacéutico, doctora en microbiología e inmunología, docente Facultad de Farmacia de la Universidad de Valparaíso y Jorge Gallardo, oncólogo de la Clínica Indisa y Presidente de la Fundación Chilena para el Desarrollo de la Oncología, fueron los dos expertos que votaron en contra. Weisntein, argumentó que faltaba información y mientras el laboratorio no presentara toda la información, su voto sería de rechazo.
Gallardo, planteó dudas en relación al diseño del estudio, la calidad de los datos presentados y el seguimiento a los voluntarios vacunados.
A su turno, la epidemióloga Teresa Valenzuela, vicedecana de Investigación de la Facultad de Medicina de la Universidad de los Andes y miembro del Consejo Asesor Covid-19, recalcó que la aprobación de esta vacuna es una autorización para “un uso de emergencia, una emergencia que está viviendo nuestro país” y en la que hay que decidir considerando “la salud pública” . “Por lo tanto, viendo la utilidad de la vacuna en la salud pública, que se busca beneficios sobre el riesgo” los antecedentes aportados para esta discusión muestran que no hay riesgo, que existe una respuesta inmune y que si bien, hay algunas preguntas que deben ser aclaradas, su recomendación es aprobar uso en adultos, hasta los 60 años.
De la misma idea fue Juan Roldán, químico farmacéutico, jefe (s) del Departamento Agencia Nacional de Medicamentos (Anamed) del ISP. Durante su alocución dijo que compartía la preocupación de los otros expertos y que “habría sido deseable más antecedentes pero considerando que es un uso de emergencia, es de utilidad de disponer esta vacuna para población que hoy no tiene alternativa para vacunarse”. En esa lógica, agregó, lod presentado es más que suficiente para prever seguridad y utilidad de la vacuna, por lo que votó por su aprobación.
Adenovirus
Esta vacuna se basa en un adenovirus tipo 5 (virus del resfriado común y el mismo que utiliza la vacuna contra el virus ébola) que es utilizado como un vehículo pero en cuyo interior, contiene información del virus SarsCoV-2.
¿Cómo funciona? En términos sencillos, esta tecnología funciona inyectando el adenovirus con capacidad de infectar las células del ser humano, pero el sistema inmune termina generando defensas contra el material que lleva en su interior este adenovirus, que en este caso es material genético de la proteína Spike (S) del virus que causa Covid-19.
La vacuna, desarrollada por CanSino, el Instituto de Biotecnología de Beijing y la Academia de Ciencias Médicas Militares, es una vacuna de vector viral similar ala de AstraZeneca y Gam-COVID-Vac de Gamaleya
Hasta ahora, la vacuna ha sido probada en personas mayores de 18 años y puede aplicarse en adultos desde los 18 años y hasta los 65 an os. No puede ser utilizada en personas con epilepsia y tampoco en mujeres embarazadas o en periodo de lactancia ya que en este grupo aún no se ha sido probada.
En los estudios clínicos que se han realizado, no se han registrado reacciones adversas severas y los más común ha sido dolor en la zona de la inyección, fiebre leve, mialgias y dolor de cabeza.
Estudio clínico en Chile
La vacuna de CanSino está siendo probada en fase tres en el país, instancia en la que participan 3.500 voluntarios
La investigación es liderada por la Universidad de La Frontera en conjunto con las universidades Austral y San Sebastián, además de centros de investigación de las ciudades de Santiago, Temuco, Valdivia, Osorno y Puerto Montt.
Además de Chile, la vacuna de CanSino fue probada en más de 42 mil voluntarios de Pakistán, Rusia, China, México y Argentina. Fernando Lanas, académico de la Universidad de La Frontera e investigador que lidera el estudio de Fase III de la vacuna CanSino en Chile, señaló que la aprobación para los menores de 60 años es justo lo que se necesita para el país, ya que los adultos mayores ya fueron vacunados.
Respecto de las dudas planteadas por el Comité de Expertos, Lanas dijo que “en tiempos normales todo los procesos de desarrollo de vacuna toman años, lo mismo las aprobación, pero dada las circunstancias de la pandemia, hay que actuar con cierto grado de incertidumbre”.
En todo caso, aclaró que respecto de la seguridad de la vacuna no hay dudas, de hecho, en los 3.500 voluntarios que participaron en el estudio nacional ninguno presentó efectos adversos relacionados con la vacuna. Hubo algunos que presentaron PCR positiva a Covid19 pero como el estudio es ramdomizado y doble ciego, aún no se puede conocer si alguna de esas personas contagiadas, estaba vacunada. En todo caso, ninguno de los contagiados, requirió hospitalización.
El investigador, también adelantó que el próximo 14 de abril se realizará la revisión final del estudio completo, incluido los antecedentes de Chile y de los otros países que también están participando, con los 40 mil participantes. Probablemente, indicó, entonces haya un pronunciamiento con más resultados y profundidad de antecedentes.

 Fonasa
Fonasa Isapres de Chile
Isapres de Chile Ministerio de Salud
Ministerio de Salud Superintendencia de Salud
Superintendencia de Salud